服务热线
400-611-2850
普略医学是国内首家专注于医学科研咨询及技术服务的公司,专门为临床医生提供科研问题解决方案。
Phone: 400-611-2850
E-mail:: service@100biotech.com
或 在线留言 给我们
1、联系与咨询。
您可通过公司的服务热线400-611-2850和服务邮箱 service@100biotech.com,或者与您联系的普略医学服务人员,告知您的科研合作需求2、签订保密协议,洽谈具体服务内容。
在双方签订合作保密协议后,您可与普略医学科研合作咨询小组进行具体项目沟通;您和普略医学双方明确服务产品需求和具体项目要求;普略医学制作和提交项目实施方案和报价。3、双方签订合同,客户按合同支付费用。
双方对合同服务内容和价格无异议后,签订服务合同。您按合同约定支付费用,并提供必要的实验药品或样品(实验样品的寄送须采用特快专递形式邮寄,有低温要求的、固定要求的,按低温保存、固定防碎方法运输,以确保安全可靠)。4、项目实施,开始为客户提供科研咨询和技术服务。
普略医学按合同方案进行项目实施。项目实施过程中,普略医学项目经理按时与客户反馈及交流信息;普略医学开始为客户提供相关科研咨询和技术服务,并及时按合同将数据、材料、样本、模型等相关信息材料提供给客户。5、分析结果资料,整理提交数据。
普略医学技术团队分析整理数据,总结结论,将完整项目实施报告和数据、图片等相关信息提供给客户,同时根据合同处理相关的实验材料。项目报告内容将包括具体实验方法、步骤、所用试剂、仪器、数据、结果和结论等。6、项目完成,协商进一步合作。
项目完成,客户如有后续科研服务需求,双方协商进一步合作。

肿瘤纳米给药机制新发现,实为主动转运而非被动过程!
发布时间:2020-11-24 16:22 文章来源:未知 作者:百替生物
1986年,Jain和Maeda的研究小组证明了蛋白质和染料可以在VX2肿瘤和S180腹水肿瘤模型中积累,确立了纳米颗粒给药的原理。1998年,Jain的研究小组通过将不同大小的脂质体注射到小鼠肿瘤模型中确定了累积的大小范围,并使用透射电子显微镜观察一些间隙,发现纳米颗粒是利用内皮细胞之间的间隙穿过肿瘤血管并积累足够的量。
科研工作者皆以该间隙的最大尺寸2000nm为依据设计纳米颗粒,30年里,纳米颗粒合成方法以及尺寸与形状调整方法的进步不断推动了癌症纳米医学领域发展。然而,经过30年的临床转化,该领域出现了质疑的声音。
2020年,加拿大多伦多大学Warren C. W. Chan等人探讨了纳米颗粒肿瘤渗透的现象,并质疑了纳米颗粒进入实体瘤的机制。该课题组发现内皮间隙并不是纳米颗粒进入实体肿瘤的原因,多达97%的纳米颗粒是通过内皮细胞的主动过程进入肿瘤的。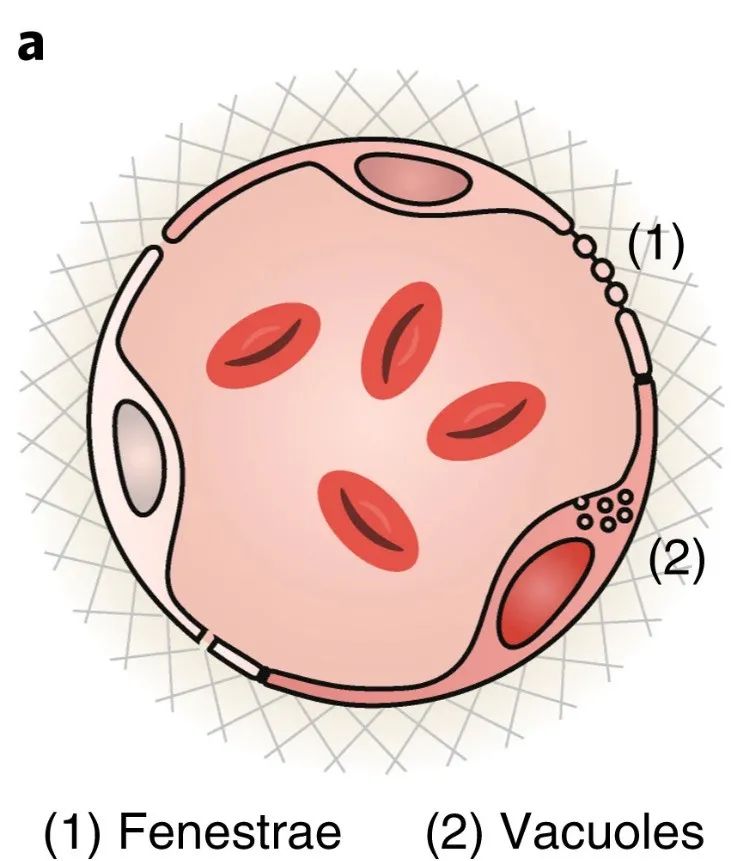
纳米颗粒的跨内皮途径示意图
肿瘤间隙的频率表征
普略医学纳米医药技术
普略医学一直以来秉承“引领医学科研,提升人类健康”、“攻克重大疾病”的愿景和使命,为社会创造转化医学价值。普略医学“研究院+转化技术平台+研发管线”的运作模式,可为医疗健康领域的进步源源不断地贡献高效创新力量。非常欢迎感兴趣的医药产业界朋友一起合作,共同发展,加速重大疾病诊疗新产品和新技术的临床转化和研发。